ادم مغزی Cerebral edema
ادم مغزی ، تجمع اضافی آب در فضاهای درون سلولی و خارج سلولی مغز می باشد.
پاتوفیزیولوژی
پاتوفیزیولوژی ادم مغزی در سطح سلولی پیچیده است. سلول های آسیب دیده متورم شده ، رگ های خونی آسیب دیده نشت می کنند ، و مسیرهای جذب مسدود شده سیال را وادار کرده تا وارد بافت های مغزی شوند. آسیب سلولی و رگ خونی ، فعال سازی زنجیره آسیب را دنبال می کنند. این زنجیره و سلسله با آزاد سازی گلوتامات به درون فضای خارج سلولی شروع می شود. ورودی کانال های سدیم و کلسیم بر روی غشاهای سلولی با تحریک گلوتامات باز می شوند. پمپ های غشای آتاپاز(آدنوزین تری فسفاتاز) تبادل یک یون کلسیم با 3 یون سدیم را بیرون می دهند. سدیم درون سلول تشکیل می شود ، یک گرادیان اسموتیک ایجاد و حجم سلول را با ورود آب افزایش می دهد. افزایش در میزان آب باعث نقص عملکرد می شود اما لزوما آسیب دائمی نیست. سرانجام ، هیپوکسی(کمبود اکسیژن خون) ، ذخایر انرژی سلول ها را تحلیل می برد که تضعیف کننده ی آتاپاز(ATPase) سدیم-پتاسیم و کاهنده ی تبادل کلسیم است.
به خاطر نقص پمپ سدیم وابسته به انرژی در غشای سلولی ، سدیم به صورت درون سلولی انباشته می شود ، و آب از فضای خارج سلولی به فضای درون سلولی برای ثابت نگه داشتن تعادل اسموتیک حرکت می کند. کلسیم داخل سلول انباشته شده و فرایندهای سیتوتوکسیک درون سلولی را فعال می کند. یک پاسخ التهابی با تشکیل سریع ژن های اولیه همچون c-foc و c-jun و سایتوکین ها و دیگر مواد بینابین شروع می شود. سلول های میکروگلیا فعال شده و رادیکال های آزاد و پروتئازها را رها می سازند که در حمله به غشاهای سلول و مویرگ ها سهیم هستند. زمانی که غشاها مختل شوند ، بازیافت سلول ها غیر ممکن است.
رادیکال های آزاد برای سلول ها سمی هستند. گونه های اکسیژن فعال همچون یون سوپراکسید ، پراکسید هیدروژن ، و یون هیدروکسیل توسط زنجیره اسید آراشیدونیک محافظت می شوند. آزادسازی اسیدهای چرب همچون اسید آراشیدونیک ذخیره مولکول های آسیب دیده را فراهم می کند. نیتریک اکسید(NO) نیز منبع رادیکال آزاد است. ماکروفاژها و سلول های میکروگلیا فعال شده از طریق عمل قابل القایی یا سینتتاز NO ایمونولوژیکی(iNOS) ، تشکیل نیتریک اکسید می دهند. در طول آسیب و ایسکمی ، میانجی گرهای سیستم عصبی مرکزی(CNS) مانند گلوتامات ، اسیدهای چرب آزاد ، یا ترکیبات پتاسیم خارج سلولی زیاد ، آزاد یا فعال می شوند که باعث ایجاد تورم ثانویه و آسیب سلول های عصبی می شوند. سایر مواد از قبیل هیستامین ، آراشیدونیک اسید و رادیکال های آزاد از جمله اکسید نیتریک نیز ممکن است میانجی گرهای ادم مغزی در نظر گرفته شوند اما برای هریک از این ترکیبات شواهد کمتری نسبت به برادی کینین مشخص است.
میانجی گرهای مختلفی ممکن است یکدیگر را در شیوه زنجیره ای با آغاز واکنش هایی که ممکن است برای مهار فارماکولوژیکی قابل بررسی باشد بهبود دهند. برادی کینین ممکن است در تشکیل ادم بعد از آسیب مغزی ضربه ای ، طناب نخاعی تروماتیک ، و آسیب مغزی ایسکمیک دخالت داشته باشد. در سکته مغزی ، زنجیره مولکولی که توسط ایسکمی مغزی شروع می شود شامل تحلیل پمپ های یونی غشا و تورم سلول می باشد. تشکیل ثانویه ی رادیکال های آزاد و پروتئازها ، غشاهای سلول مغز را مختل نموده ، و آسیب برگشت ناپذیر را به وجود می آورد.
انواع ادم مغزی
چهار نوع ادم مغزی تشخیص داده شده است:
ادم مغزی وازوژنیک:
ادم مغزی وازوژنیک به واسطه ی آسیب دیدگی اتصالات محکم اندوتلیال که سد خونی مغزی(BBB) را می سازند به وجود می آید. این معمولا از نفوذ پروتئین های درون آوندی و مایع درون فضای خارج سلولی پارانشیمی جلوگیری به عمل می آورد. زمانی که محتویات پلاسما ، به سد خونی مغزی برسد ، ادم گسترش می یابد که این پیشروی ممکن است خیلی سریع و گسترده باشد. زمانی که آب وارد ماده سفید شود در امتداد راه های فیبری به صورت خارج سلولی حرکت کرده و می تواند بر روی ماده ی خاکستری نیز تاثیر بگذارد. این نوع از ادم در پاسخ به تروما ، تومور ، التهاب موضعی ، مراحل پایانی ایسکمی مغزی و انسفالوپاتی هیپرتانسیو مشاهده می شود.
ادم وازوژنیک اشاره به جریان سیال و محلول ها به درون مغز از طریق سد خونی مغزی(BBB) ناکارآمد دارد. این ادم رایج ترین نوع ادم مغزی است و در اثر افزایش نفوذپذیری سلول های اندوتلیال مویرگی ایجاد می شود ، ادم وازوژنیک در درجه اول بر روی ماده سفید تاثیر می گذارد. اختلال در سد خونی مغزی امکان حرکت پروتئین ها از فضای درون آوندی از طریق دیواره مویرگی به فضای خارج سلولی را فراهم می کند.
در ادم وازوژنیک ، مشکل اصلی در اختلال سد خونی مغزی متمرکز می شود ، که سبب افزایش نفوذپذیری و برون رفت سیال از فضای داخل آوندی به فضای خارج آوندی ، و خارج سلولی می شود. این ادم همراه با تومورها ، ضایعات التهابی ، و آسیب بافتی تروماتیک می باشد. ادم وازوژنیک تمایل دارد تا در ماده سفید مغز غالب شود. بعضی از مکانیسم های کمک کننده به اختلال سد خونی مغزی عبارتند از: اختلال فیزیکی توسط هایپرتانسیون یا پرفشاری شریانی یا تروما ، آزادسازی تسهیل کننده ی تومور از ترکیبات مخرب وازواکتیو و اندوتلیال(برای مثال ، اسید آراشیدونیک ، پیام رسان های عصبی محرک ، ائیکوسانوئیدها ، برادی کینین ، هیستامین و رادیکال های آزاد).
ادم مغزی در ارتفاع بالا:
همه ی ما از منظره ی عظیم و فوق العاده ای كه از یك قله ی مرتفع دیده می شود لذت می بریم ، ولی خطراتی در رفتن به ارتفاعات وجود دارد و دانستن این خطرات بسیار مهم است. هیچ عامل خاصی اعم از سن ، جنس یا شرایط فیزیولوژیك لازمه ی مستعد بودن فرد به بیماری ارتفاع نیست. بعضی افراد مبتلا می شوند و برخی نمی شوند و برخی برای ابتلا به این بیماری مستعدتر هستند. بیشتر افراد می توانند تا ارتفاع 2500 متری با حداقل تاثیر بالا بروند. اگر قبلاً به ارتفاعات نرفته اید باید محتاط باشید. اگر قبل از این به آن ارتفاع رفته اید و مشكلی نداشته اید به احتمال زیاد بدون هیچ مشكلی می توانید دوباره به همان ارتفاع برگردید. چرا كه شما به خوبی با شرایط وفق پیدا كرده اید.
علل بیماری صعود در ارتفاع:
در سطح دریا غلظت اكسیژن در حدود 21 درصد است و فشار بارومتری به طور میانگین 760 میلی متر جیوه است. با زیاد شدن ارتفاع ، غلظت در همان حد باقی می ماند ولی تعداد مولكول های اكسیژن در هر تنفس كاهش می یابد. در ارتفاع 3500 متری فشار بارومتری تنها 483 میلیمتر جیوه است. یعنی تقریباً 40 درصد كاهش در مولكول های اكسیژن موجود در هر تنفس. جهت اكسیژن رسانی مناسب به بدن سرعت تنفس(حتی در هنگام استراحت) باید افزایش یابد. این تهویه ی اضافی میزان اكسیژن خون را بالا می برد ولی نه در حد غلظت اكسیژن در سطح دریا. از آنجایی كه مقدار اكسیژن مورد نیاز برای فعالیت تغییری نكرده است ، بدن می بایست خود را با مقدار اكسیژن کمتری تطبیق دهد. به علاوه به دلایلی كه كاملاً مشخص نیست ، ارتفاع زیاد و فشار كمتر هوا باعث نشت مایع از مویرگ ها می شود كه همین عامل می تواند باعث افزایش مایع در ریه و مغز شود. ادامه مسیر به سمت ارتفاعات بالاتر بدون عادت كردن(هم هوایی) و وفق یافتن با محیط می تواند به بیماری های شدید و حتی تهدیدكننده ی حیات منجر شود.
دلیل اصلی بیماری صعود در ارتفاع ، رفتن به بلندی ها با سرعت زیاد است. با صرف وقت بیشتر، بدن می تواند خود را با كاهش تعداد مولكول های اكسیژن در یك ارتفاع مشخص سازگار كند. این مراحل بهعنوان وفق دادن(هم هوایی) یا عادت كردن شناخته می شود و عموماً 1 الی 3 روز برای هر ارتفاعی وقت می گیرد. برای مثال اگر تا ارتفاع 3000 متری بالا بروید و چندین روز را در آن ارتفاع بمانید بدن شما به ارتفاع 3000 متری عادت می كند. اگر تا ارتفاع 6500 متری بالا بروید بدن دوباره به آن ارتفاع عادت می كند. تغییرات زیادی رخ می دهد تا بدن اجازه عمل با اكسیژن كاهش یافته را پیدا كند. افزایش عمق هر تنفس افزایش فشار سرخرگ های ریوی خون را مجبور می كند كه در قسمت هایی از ریه كه در حالت عادی در ارتفاع دریا از آنها استفاده نمی شود ، جریان پیدا كند. بدن گلبول های قرمز بیشتری جهت حمل اكسیژن تولید می كند. بدن آنزیم خاصی كه اكسیژن رسانی را تسهیل می كند ، بیشتر تولید می كند.
پیشگیری از بیماری صعود در ارتفاع:
پیشگیری از بیماری صعود در ارتفاع به دو دسته تقسیم می شود: وفق دادن (هم هوایی) مناسب و داروهای پیشگیری كننده. چند راهنمایی جهت وفق دادن(هم هوایی) مناسب در ذیل آورده شده: اگر امكان آن هست ، راهپیمایی را از ارتفاع كمتر از 3000 متری شروع كنید و بالا بروید. در 24 ساعت اول از تلاش بیش از حد یا حركت به سمت ارتفاعات بیشتر خودداری كنید. اگر به ارتفاعات بیش از 3000 متری می روید ، در هر روز تنها 300 متر ارتفاع خود را افزایش دهید و در ازای هر1000 متر بالا رفتن یك روز استراحت كنید. به ارتفاع بالاتر بروید و در ارتفاع كمتر بخوابید. این روش بسیار زیاد توسط كوهنوردها استفاده می شود. می توانید در یك روز بیش از300 متر بالا بروید و برای خواب به ارتفاعات پایین تر برگردید. اگر علایم خفیف بیماری صعود در ارتفاع را دارید ، بالاتر نروید تا زمانی كه علایم كاهش یابد(بالا نروید قبل از اینكه علایم پایین بیاید). اگر علایم افزایش یافت ، پایین ، پایین و پایین تر بروید. به خاطر داشته باشید كه افراد مختلف با سرعت های متفاوت به محیط عادت می كنند. قبل از اینكه به ارتفاع بالاتر صعود كنید از اینكه همه افراد گروه به محیط عادت كرده اند اطمینان حاصل نمایید. آب كافی به بدن برسانید. عادت كردن به محیط (هم هوایی با محیط) معمولاً با از دست دادن مایع همراه است. بنابراین بایستی مایع زیادی بنوشید تا آب كافی به بدن برسد(حداقل 4-3 لیتر در روز). ادرار باید فراوان و شفاف باشد. به خود سخت نگیرید ، تلاش بیش از حد در بدو ورود به ارتفاعات نداشته باشید. فعالیت های سبك در طول روز از خوابیدن بهتر است چرا كه تنفس در طول خواب كاهش یافته و علایم را وخیم تر می كند. از دخانیات و الكل و دیگر داروهای آرامبخش شامل باربیتورات ها ، مسكن ها و قرص های خواب اجتناب كنید. این آرام بخش ها تنفس را در طول خواب بیش از پیش كاهش می دهند و منجر به بدتر شدن علایم می شوند. تا زمانی كه در ارتفاعات هستید ، رژیم با كربوهیدرات بالا(بیش از 70 درصد از كالری از كربوهیدرات ها) داشته باشید. روند وفق دادن (هم هوایی) با آب رسانی ناكافی به بدن ، تلاش بیش از حد و الكل و دیگر داروهای آرام بخش متوقف می شود. داروهای پیشگیری كننده: دیاموكس(استازولامید) به شما اجازه می دهد تا سریع تر تنفس كنید. پس اكسیژن بیشتری را متابولیزه می كنید درنتیجه علایمی كه به علت اكسیژن رسانی ضعیف ایجاد شده به حداقل می رسد. این مورد بخصوص در شب كه فعالیت تنفسی كاهش دارد مفید می باشد. از آنجا كه برای تاثیرگذاری دیاموكس وقت لازم است توصیه می شود كه 24 ساعت قبل از رفتن به ارتفاع مصرف شود و حداقل برای 5 روز در ارتفاعات بالاتر مصرف ادامه یابد. دوز پیشنهادی داروی مصرفی 250 میلی گرم هر 8 ساعت می باشد. اثرات جانبی ممكن عبارت است از سوزش و مورمور لب ها و نوك انگشتان و دفع ادرار بیشتر. این اثرات جانبی احتمالا در روزهای بعدی كاهش می یابند. اثرات جانبی با قطع دارو از بین می روند. جهت راهنمایی با پزشك خود تماس بگیرید. از آنجا كه دیاموكس یك سولفانامید است ، افرادی كه به سولفانامیدها حساسیت دارند نباید از دیاموكس استفاده كنند.
بیماری حاد كوهستان (AMS):
AMS در ارتفاعات بالای 3000 متر شایع است. در صعود بیش از 3000 متر 75 درصد افراد علایم خفیف خواهند داشت. میزان بروز AMS به ارتفاع ، به سرعت صعود و ویژگیهای فردی بستگی دارد. افراد زیادی AMS خفیف را در طول روند(هم هوایی) با محیط تجربه می كنند. علایم معمولا 6 الی 12 ساعت بعد از رسیدن به ارتفاع شروع می شوند و در حدود روز سوم كاهش شدت علایم را خواهیم داشت. علایم AMS خفیف عبارتند از سردرد، گیجی ، خستگی ، كوتاهی تنفس ، كاهش اشتها ، تهوع ، اختلال خواب و احساس عمومی درد ماهیچه می باشد. علایم در شب بدتر می شوند چرا كه سرعت تنفس كاهش می یابد. AMS خفیف مانعی برای فعالیت های معمولی نیست و علایم عموما در روزهای ا تا 3 هنگامی كه بدن به شرایط عادت می كند ، از بین می رود. تا زمانی كه علایم خفیف هستند صعود می تواند با سرعت متوسطی ادامه پیدا كند هنگام صعود ، بایستی هر علامتی از بیماری را فورا با دیگر اعضای گروه در میان بگذارید. AMS به عنوان یك اشكال نورولوژیك كه بوسیله ی تغییرات سیستم عصبی مركزی به وجود می آید ، در نظر گرفته می شود. این بیماری اصولا فرم تخفیف یافته ادم مغزی در ارتفاعات می باشد. درمان اولیه AMS تنها درمان هم هوایی با محیط یا كاهش ارتفاع است. علایم AMS خفیف را می توان با داروی ضد درد برای سردرد و دیاموكس درمان كرد. هر دو دارو به كاهش شدت علایم كمك می كنند ولی به یاد داشته باشید كه تخفیف علایم ، درمان مشكل نیست. دیاموكس به شما اجازه می دهد كه سریعتر نفس بكشید در نتیجه اكسیژن بیشتری را متابولیزه می كنید پس علایمی كه به علت اكسیژن رسانی ضعیف ایجاد شده بود تخفیف می یابد. بهتر است استفاده آزمایشی از دارو را قبل از رفتن به مكان های دور از دسترس ، كه واكنش های شدید آلرژیك عملاً سخت درمان می شوند ، توصیه می شود. AMS متوسط شامل سردرد شدیدی كه با دارو درمانی بهتر نمیشود ، تهوع و استفراغ پیش رونده و ضعف ، كوتاهی تنفس و كاهش هماهنگی اندام ها(آتاكسی) می باشد. فعالیت های معمولی مشكل می شود اگرچه فرد ممكن است هنوز بتواند خودش به تنهایی راه برود. در این مرحله تنها دارو درمانی پیشرفته تر و یا كاهش ارتفاع می تواند مشكل را رفع كند. كاهش ارتفاع حتی در حد چند صد متر می تواند كمك كننده باشد و بهبود قطعی در كاهش ارتفاع در حد 300 الی 600 متر دیده می شود. 24 ساعت ماندن در ارتفاع پایین تر به بهبود قابل ملاحظه منجر می شود. فرد باید در ارتفاع پایین تر بماند تا جایی كه علایم متوقف شود(تا 3 روز). در این مرحله فرد به آن ارتفاع عادت كرده است و می تواند صعود را ادامه دهد. بهترین تست در تشخیص AMS متوسط این است كه از فرد بخواهیم در یك مسیر مستقیم راه برود . فرد دچار آتاکسی نمی تواند این مسیر را طی كند این مورد اندیكاسیون واضحی بر لزوم كاهش ارتفاع است. مهم است كه فرد را به ارتفاع پایین تر ببریم قبل از اینكه آتاكسی در حدی پیشرفت كند كه فرد نتواند خودش به تنهایی راه برود(كه در این حالت برگشت به ارتفاع پایین تر با حمل با برانكارد لازم است). AMS شدید با تشدید علایم فوق الذكر در مورد AMS متوسط شناخته می شود. شامل كوتاه شدن تنفس در استراحت ، ناتوانی در راه رفتن ، كاهش سطح فعالیت های مغزی و افزایش مایع در ریه ها. در AMS شدید كاهش ارتفاع فوری لازم است(600-1200 متر).
ادم مغزی در ارتفاع زیاد(HACE) و ادم ریوی در ارتفاع زیاد(HAPE):
این دو مورد كمتر اتفاق می افتند به خصوص در افرادی كه به طور مناسب با ارتفاع وفق داده شده اند. این دو بیماری بطور معمول در افرادی كه خیلی سریع مسافت زیادی را بالا می روند و در آن ارتفاع زیاد می مانند دیده می شود. كمبود اكسیژن منجر به نشست مایع از میان دیواره های مویرگی به مغز یا ریه می شود. ادم ریوی در ارتفاع زیاد زیاد(HAPE) از افزایش مایع در ریه ها نتیجه می شود. وجود مایع در ریه از تبادل اكسیژنی موثر جلوگیری می كند. با شدت یافتن شرایط ، سطح اكسیژن در جریان خون پایین می آید كه این امر منجر به اختلال عملكرد مغزی و مرگ می شود. علایم شامل كوتاه شدن تنفس حتی در حالت استراحت ، ضعف واضح ، احساس خفگی قریب الوقوع در شب ، خستگی و سرفه های خلط دار دائمی با خلط سفید ، آبكی یا كف آلود می باشد. گیجی و رفتار نامعقول علایم دیسترس مغز به اكسیژن كافی هستند. یكی از روش هایی كه می توانید خود را در مورد HAPE بیازمایید ، بررسی زمان برگشت به حالت طبیعی بعد از فعالیت است. اگر سرعت ضربان قلب و تنفس در حالت عادی مثلاً در x ثانیه پس از فعالیت به حالت عادی برمی گردد ولی در ارتفاع این زمان برگشت به حالت طبیعی خیلی بیشتر است ، این علامت احتمالا نشان می دهد كه مایع در ریه های شما افزایش یافته است. در موارد HAPE كاهش ارتفاع فوری لازم می باشد و می تواند زندگی فرد را نجات دهد(600-1200 متری). هر فردی با علایم HAPE باید با برانكارد به جایی كه تسهیلات پزشكی جهت پیگیری مناسب درمان وجود دارد ، منتقل شود.
ادم مغزی در ارتفاع زیاد(HACE) شکل وخیمی(گاهی اوقات مرگ آور) از بیماری صعود به ارتفاع است. HACE در نتیجه ی تورم بافت مغزی به علت نشت مایعات مویرگ ها به واسطه ی اثرات هیپوکسی در سلول های اندوتلیال غنی از میتوکندری سد خونی مغزی است.
علایم می تواند شامل سردرد ، كاهش هماهنگی اندامها (آتاكسی) ضعف و کاهش سطح هوشیاری شامل عدم آگاهی نسبت به زمان و مكان ، كاهش حافظه ، توهم ، رفتار روان پریشانه و كوما باشد. این حالت عموما پس از یك هفته یا بیشتر توقف در ارتفاع زیاد ایجاد می شود. موارد شدید ، در صورت عدم درمان سریع به مرگ منجر خواهند گردید. كاهش ارتفاع فوری لازم است و می تواند جان فرد را نجات دهد. بعضی داروها می توانند در درمان به كار روند اما به آموزش مناسب در نحوه ی مصرف آنها ، نیاز می باشد. هر فردی كه علایم HACE را داشته باشد بایستی با برانكارد به جایی كه امكانات پزشكی برای پیگیری مناسب درمان وجود دارد برده شود.
گاموبگ در درمان بیماری های ارتفاع استفاده می شود. این کیسه از یك محفظه ی عایق بندی شده كه یك پمپ دارد تشكیل شده است. فرد درون كیسه قرار می گیرد و این كیسه باد می شود. پمپ كردن به داخل كیسه پر از هوا غلظت مولكول های اكسیژن را به طور مؤثری بالا می برد و بنابراین شرایط پایین آمدن به ارتفاع پایین تر را تقلید می كند. در كمتر از 10 دقیقه كیسه می تواند شرایطی شبیه شرایط 1500-900 متر پایین تر را ایجاد كند. بعد از یك تا دو ساعت حضور در كیسه شرایط شیمیایی بدن فرد در ارتفاع پایین تری مجددا تنظیم میشود. این تنظیم برای 12 ساعت خارج از كیسه ادامه دارد كه این مدت برای آوردن فرد به ارتفاع پایین تر و اجازه هم هوایی بیشتر كافی به نظر می رسد. تنفس شین- استوك بالاتر از ارتفاع 3000 متر پایی: بیشتر افراد تنفس های دوره ای را در خواب به اسم تنفس شین استوك تجربه می كنند. الگوی تنفس با تعدادی تنفس سطحی شروع می شود و به صورت تنفس های عمیق ادامه می یابد و سپس به سرعت افت می كند. بعد از آن تنفس کلا به مدت چند ثانیه قطع می شود و سپس تنفس های سطحی دوباره شروع می شود. در این مدت وقتی كه تنفس متوقف می شود فرد معمولا نا آرام می شود و با احساس ناگهانی خفگی از خواب بیدار می شود. بدین ترتیب الگوی خواب مختل می شود و كوهنورد خسته می شود. استازولامید در بهبود تنفس دوره ای كمك كننده است. این نوع تنفس در ارتفاع زیاد غیر طبیعی تلقی نمی شود. اگرچه در صورتی که در ابتدای یك بیماری(به جز بیماری های ارتفاع) یا بعد از یك جراحت ایجاد شود ، میتواند نشانه یك اختلال جدی باشد.
ادم مغزی سیتوتوکسیک:
در این نوع از ادم سد خونی مغزی(BBB) سالم باقی می ماند. این ادم به علت اختلال در متابولیسم و سوخت و ساز سلولی منجر به عملکرد نامناسب پمپ سدیم و پتاسیم در غشای سلول گلیال می شود. در نتیجه ، بازدارش یا احتباس سلولی از سدیم و آب وجود دارد. آستروسیت های متورم در ماده خاکستری و ماده سفید وجود دارند. ادم سیتوتوکسیک با مسمومیت های مختلفی (دینیتروفنول ، تری اتیلتین ، هگزاکلروفن ، ایزونیازید) ، در سندرم رای ، هیپوترمی شدید ، ایسکمی اولیه ، انسفالوپاتی ، سکته مغزی اولیه یا هیپوکسی ، ایست قلبی ، سربری شبه تومور ، و تاکسین های مغزی مشاهده می شود.
ادم مغزی سیتوتوکسیک اشاره به یک تورم سلولی دارد و در بیماری هایی همچون آسیب سر و هیپوکسی دیده می شود. این ادم ناشی از تورم سلول های مغز ، احتمالا به دلیل آزادسازی فاکتورهای تاکسیک از نوتروفیل ها و یا باکتری ها است. ادم سیتوتوکسیک با تورم گلیا ، نورون ها ، سلول های اندوتلیال ایجاد می گردد و در عرض چند دقیقه بعد از آسیب شروع می شود. در ادم سیتوتوکسیک ، افزایش مقدار آب به صورت درون سلولی تجمع می یابد و به واسطه ی نقص پمپ های یونی ، همئوستاسیز سلولی را ثابت نگه می دارند. ایسکمی و اختلالات متابولیکی فراوان از شایعترین علل هستند. این ادم عمدتا بر روی ماده خاکستری تاثیر می گذارد.
ادم بافت بینابینی:
این نوع ادم در هیدروسفالی بازدارنده به وجود می آید. این شکل از ادم به علت پارگی سد مغزی-مایع مغزی نخاعی حاصل شده در جریان ترانس-اپندیمال از مایع مغزی-نخاعی می باشد که سبب نفوذ مایع مغزی نخاعی به مغز و گسترش به فضاهای خارج سلولی و ماده سفید می گردد. مایع مغزی نخاعی ادم بافت بینابینی تقریبا حاوی هیچ پروتئینی نمی باشد لذا از ادم وازوژنیک متمایز می شود.
ادم بینابینی به علت افزایش جریان ترانس اپندیمال از بخش درون بطنی به پارانشیم مغز به وجود می آید. بروز آن معمولا در شروع هیدروسفالوس مخرب است. ادم مغزی بینابینی در هیدروسفالی زمانی مشاهده می شود که جریان به بیرون مایع مغزی نخاعی مسدود شده و فشار درون بطنی افزایش یابد. نتیجه ، حرکت سدیم و آب در دیواره ی بطنی درون فضای پارا ونتریکولار است. این ادم در مننژیت بروز می کند که تا حد زیادی به واسطه ی انسداد مسیرهای نرمال مایع مغزی با افزایش حاصله در مقاومت به جریان به بیرون مایع مغزی نخاعی می باشد.
ادم وازوژنیک و سیتوتوکسیک اغلب باهم وجود دارند. برای نمونه ، اوایل بعد از انفارکتوس مغزی ایسکمیک ، ادم سیتوتوکسیک چشمگیر است اما بعدها ادم وازوژنیک علت اصلی تباه شدگی سد خونی مغزی و التهاب موضعی می شود.
اتیولوژی
ادم مغزی در بیماری های نورولوژیکی و غیر نورولوژیکی زیر مشاهده می شود:
بیماری های نورولوژیکی:
سکته مغزی ایسکمیک و خونریزی داخل مغزی
تومورهای مغزی
مننژیت و انسفالوپاتی
سایر عفونت های مغزی مانند سل ، توکسوپلاسما
بیماری های غیر نورولوژیکی:
کتواسیدوز دیابتی ، کما اسیدوتیک لاکتیک
هیپرتانسیون بدخیم ، انسفالوپاتی هیپرتنسیو
هپاتیت ویروسی بسیار حاد ، انسفالوپاتی هپاتیک ، سندرم رای
مسمومیت سیستمیک(کربن مونواکسید و سرب)
هیپوناترمی ، SIADH
سوء مصرف و وابستگی به داروی خواب آور یا آرام بخش
ادم مغزی در ارتفاع بالا(HACE)
ICP ، فشار داخل جمجمه ای
CBF ، جریان خون مغزی ، که برای رساندن اکسیژن و حذف مواد زاید مهم می باشد.
CPP فشار پرفیوژن مغزی ، که فشار موثر به حرکت درآورنده خون در مغز می باشد.
اجزای تشکیل دهنده ی اصلی داخل جمجمه عبارتند از ، مغز(80 درصد) ، خون(12 درصد) و مایع مغزی نخاعی(8 درصد). حجم کل داخل جمجمه 1600 میلی لیتر است. در صورتی که حجم محتویات داخل جمجمه افزایش یابد ، فشار داخل جمجمه ای به صورت قابل ملاحظه افزایش خواهد یافت مگر آنکه برخی مایعات از جمجمه و مغز خارج شود.
در محفظه سخت جمجمه ، بافت مغزی(1400 g) ، خون(75 ml) و مایع مغزی-نخاعی(75 ml) جای می گیرند. حجم و فشار این سه ترکیب معمولا در حالت تعادل قرار دارند و ICP را به وجود می آورند. ICP معمولا در بطن های جانبی اندازه گیری می شود ، ICP طبیعی بین 10 تا 20 میلی متر جیوه است. بالاترین حدی که می توان آن را طبیعی در نظر گرفت ، 15 mmHg است.
فرضیه مونرو-کلی: این فرضیه این گونه بیان می دارد که به دلیل محدودیت فضا جهت گستردگی محتویات درونی جمجمه ، هرگونه افزایش در هریک از ترکیبات موجود در آن سبب بروز تغییر در حجم اجزای دیگر می شود. از آنجا که بافت مغزی فضای محدودی جهت تغییر در اختیار دارد ، لذا مکانیسم جبرانی معمولا با تغییر مکان یا جابجایی مایع مغزی-نخاعی ، افزایش جذب یا کاهش تولید مایع مغزی نخاعی ، یا کاهش حجم خون مغزی همراه می باشد. بدون انجام چنین تغییراتی ، ICP شروع به بالارفتن خواهد نمود. در شرایط طبیعی ، با بروز تغییراتی در فشار داخل قفسه سینه(سرفه ، عطسه و زور زدن) ، وضعیت بدن ، فشار خون و نوسانات موجود در سطح گازهای خون شریانی ، تغییراتی جزئی در حجم خون و حجم CSF پدید می آید که طبیعی در نظر گرفته می شود.
مغز بر خلاف کلیه ، کبد یا عضله ، تنها می تواند دوره های خیلی کوتاهی از ایسکمی را تحمل کند. لذا ، جریان خون مغز بایستی برای اکسیژن رسانی و گلوکز همچنین حذف مواد زاید ثابت نگه داشته شود. ثابت نگهداشتن جریان خون مغزی به توازن مابین فشار داخل جمجمه ای(ICP) و فشار شریانی میانگین(MAP) بستگی دارد. ثابت نگه داشتن جریان خون مغزی امری ضروری است.
زمانی که فشار خون افت می کند ، مکانیزم های فیزیولوژیکی تلاش می نمایند تا جریان خون مغزی را برای پیشگیری از ایسکمی حفظ نمایند. این فرایند اتورگلاسیون یا تنظیم خودکار نامیده می شود. به طور مشابه ، زمانی که فشار خون افزایش می یابد ، مکانیزم مشابه باعث جلوگیری از افزایش جریان خون به سطوح بیش از اندازه می شود. در صورتی که این اتفاق روی دهد ، ادم مغزی می تواند ایجاد شود و مغز به واسطه ی افزایش در حجم خون شریانی مغزی متورم خواهد شد.
در صورت متورم شدن مغز ، مقداری خون یا مایع مغزی نخاعی جهت جلوگیری افزایش در فشار بایستی خارج شوند. در صورتی که این عمل قادر به انجام شدن نباشد ، افزایش سریع ICP در محدوده نرمال وجود خواهد داشت(5-13 mmHg). در صورت وجود افزایش در حجم مغز یا خون ، پاسخ نرمال اولیه شامل کاهش در حجم مایع مغزی نخاعی داخل جمجمه است. مایع مغزی نخاعی مجبور به خارج شدن درون کیسه نخاعی می گردد. بنابراین ICP در ابتدا ثابت نگه داشته می شود. بالاخره ، این فرایند با تحلیل سینوس های وریدی از توان انداخته شده و CSF کم یا ناچیزی در مغز وجود خواهد شد. هر گونه افزایش بیشتر در حجم مغز باعث افزایش سریع در ICP می گردد.
افزایش فشار داخل جمجمه ای بسیاری از بیماران مبتلا به بیماری های حاد عصبی را گرفتار می سازد زیرا موقعیت های بیماری زا رابطه میان حجم و فشار موجود در داخل جمجمه را برهم می زنند. اگرچه بالارفتن ICP به طور شایع با آسیب دیدگی های سر به وجود می آید اما به عنوان اثر ثانویه همراه با بیماری های مختلف دیگر نظیر تومورهای مغزی ، خونریزی ساب آراکنوئید یا زیر عنکبوتیه ای ، انسفالوپاتی های ویروسی و توکسیک نیز مشاهده می شود. افزایش فشار داخل جمجمه ای بنا به هر دلیلی که ایجاد شده باشد در خون رسانی و یا پرفیوژن مغزی تاثیر گذاشته و منجر به افزایش تورم و ادم خواهد گردید و بافت های مغزی را به سمت سوراخ های واقع در لایه محکم سخت شامه هدایت می نماید ، پدیده ای که فتق یا هریناسیون(herination) نامیده می شود و رویدادی حاد و غالبا کشنده می باشد.
تورم مغز به دو شکل به فتق مغزی منجر می گردد ، به صورت درونی زمانی که لب آهیانه ای بر روی مغز میانی از طریق تنتوریوم یا incisura به پایین فشار داده شود یا به صورت بیرونی زمانی که با پدانکول های مخچه ای از طریق سوراخ مگنوم به پایین فشار داده شود. زمانی که افزایش در ICP با فشار شریانی مقابله می کند باعث پیچش ساقه مغز و کاهش جریان خون مغزی موضعی می شود. سرانجام کاهش فشار پرفیوژن مغزی به نقطه ای می رسد که هیچ جریان خون مغزی و پرفیوژن مغزی وجود نداشته و منتهی به مرگ می شود. این با پیچش ساقه مغز ایجاد شده که به انسداد ناگهانی جریان خونی مغز منجر می گردد.
شناخت تغییرات فیزیولوژیکی که جریان خون مغزی(CBF) را نگه می دارند و تغییرات در حجم مغز را تعدیل می کنند آسان است. به دنبال تروما یا بیماری داخل جمجمه ، تغییرات اضافی روی می دهند. کنترل موفق بیماران تکیه بر شناخت روشن مکانیزم های فیزیولوژیکی و تاثیر اضافه شده از بیهوشی و مدیریت فشار شریانی ، فشارهای CO2 و O2 دارد. تکنیک های ضعیف هوشبری که امکان سرفه کردن ، رگ به رگ شدگی ، هیپوتانسیون(کم فشاری خون) ، هایپرتانسیون(پرفشاری خون) ، هیپوکسی ، و هایپرکاربیا را فراهم می کنند شدیدا به مغز آسیب خواهند زد. نتایج بهتر با مانیتورینگ دقیق بیمار و توجه به جزئیات ساده با مداخلات فارماکولوژیکی پیچیده بدست خواهند آمد.
افزایش ICP می تواند به نحو چشمگیری سبب کاهش جریان خون مغز و در نتیجه ایسکمی و نیز مرگ سلول گردد. در مراحل اولیه ایسکمی مغزی ، مراکز وازوموتور تحریک شده و فشار سیستمیک بالا می رود تا جریان خون مغزی حفظ گردد. این عمل معمولا با کند شدن ضربانات قلب و نامنظم شدن ریتم تنفسی همراه است. بروز این تغییرات در فشار خون ، نبض و تنفس از نظر بالینی حائز اهمیت می باشند چرا که افزایش ICP را مطرح می سازند.
تجمع دی اکسید کربن در خون و بافت مغزی نیز می تواند سبب تنظیم جریان خون مغز گردد. بالارفتن فشار نسبی دی اکسید کربن PaCO2 اتساع عروق را به دنبال دارد ، که به نوبه ی خود منجر به افزایش جریان خون مغزی و افزایش ICP می گردد. کاهش PaCO2 سبب تنگ شدگی و انقباض عروقی شده و جریان خون وریدی را محدود می سازد. کاهش جریان خروجی وریدی نیز می تواند با افزایش حجم خون مغزی موجب بالارفتن ICP گردد.
ادم مغزی زمانی ایجاد می شود که میزان آب موجود در فضای داخل سلولی ، فضای خارج سلولی یا هر دو به طور غیر طبیعی افزایش یافته و با بالارفتن حجم بافت های مغزی همراه باشد. ادم مغزی در ماده سفید ، خاکستری یا بینابینی ایجاد شود. با تورم بافت مغزی در درون محفظه ی سخت جمجمه ، چندین مکانیزم در این رابطه عمل می نمایند تا به جبران افزایش ICP بپردازند. این مکانیزم ها عبارتند از: اتورگلاسیون و کاهش تولید و جریان CSF. به توانایی مغز در تغییر قطر عروق خونی خود به صورت اتوماتیک اطلاق می شود تا در خلال تغییرات به وجود آمده در فشار خون سیستمیک ، جریان خون مغزی ثابت باقی مانده و متحمل تغییر نشود. این مکانیزم در بیماران دچار وضعیت های پاتولوژیک که ICP در آنها بالارفته با اختلال مواجه می شود.
با افزایش ICP ، مکانیزم های جبرانی مغز شروع به کار می کنند تا جریان خون حفظ شده و از تخریب بافتی نیز جلوگیری به عمل آید. وقتی که فشار خون سیستولیک شریانی 50-150 mmHg می باشد و ICP نیز کمتر از 40 mmHg باشد ، مغز باز هم می تواند فشار پرفیوژن ثابتی را ایجاد نماید. تغییرات ICP رابطه نزدیکی با فشار پرفیوژن مغز(CPP) دارند. فشار پرفیوژن مغز با تفاضل ICP از فشار شریان اصلی(MAP) به دست می آید. CPP طبیعی بین 70-100 mmHg است. با بالارفتن ICP ، مکانیزم اتورگلاتوری یا خودتنظیمی مغز درهم شکسته می شود و فشار پرفیوژن مغز می تواند به میزان بیش از 100 mmHg یا کمتر از 50 mmHg برسد. بیماران دارای فشار پرفیوژن مغزی کمتر از 50 mmHg دچار آسیب های غیر قابل برگشت عصبی خواهند شد ؛ بنابراین برای اطمینان از خون رسانی کافی به مغز ، CPP باید در حد 70-80 mmHg حفظ شود. اگر ICP با فشار شریانی اصلی برابر شود ، جریان خون مغزی متوقف می گردد.
یکی از پدیده های بالینی که به عنوان پاسخ کوشینگ شناخته می شود(یا رفلکس کوشینگ) ، در مواقع کاهش شدید جریان خون مغزی به وقوع می پیوندد. در موارد بروز ایسکمی ، مراکز وازوموتور در تلاش برای غلبه بر افزایش ICP فشار شریانی را بالا می برند. پاسخی که با واسطه ی سیستم سمپاتیک انجام می گیرد سبب افزایش فشار خون سیستولیک همراه با افزایش فشار نبض و کند شدن ضربانات قلب می گردد. این پاسخ که با واسطه ی سیستم عصبی سمپاتیک صورت می پذیرد به صورت بالینی با بالارفتن فشار خون سیستولیک ، افزایش فشار نبض و کندشدن رفلکسی سرعت ضربانات قلب مشهود می باشد و علامتی است که به مداخله فوری نیاز دارد ، اگرچه در صورت درمان سریع پاسخ کوشینگ ، پرفیوژن قابل اصلاح خواهد بود.
وقتی حجم یا فشار به حد معینی برسد ، دیگر مغز قادر به انجام اتورگلاسیون به نحو موثر نبوده ، جبران سازی(ایسکمی و انفارکتوس) صورت نمی گیرد. در این مرحله ، بیمار دچار تغییرات چشمگیری در وضعیت ذهنی و علایم حیاتی خواهد شد. از آن جمله: برادی کاردیا ، کاهش ضربان قلب ، هایپرتانسیون یا پرفشاری خون و تغییرات تنفسی همراه با این تحلیل رفتگی که موسوم به علامت تریاد کوشینگ می باشند. . اگر در این مرحله اقدامات درمانی آغاز نگردد ، در آن صورت ساقه مغز دچار بیرون زدگی شده و جریان خون مغزی مسدود خواهد شد. فتق مغزی زمانی اتفاق می افتد که بخشی از بافت مغز از ناحیه ای که فشار در آنجا بالا است به طرف ناحیه ی دارای فشار پایین جابجا شود. بافت بیرون زده بر قسمتی از مغز که به آنجا نقل مکان کرده فشار وارد می آورد و سبب اختلال در ذخیره ی خونی آن ناحیه می گردد. قطع جریان خون مغزی منجر به بروز ایسکمی و انفارکتوس و در نتیجه مرگ مغزی می گردد.
علائم بالینی
زمانی که افزایش فشار داخل جمجمه ای تا آنجا پیش روی کند که توانایی مغز بیمار جهت انطباق به حدود خود برسد ، عملکرد نورون ها با اختلال مواجه می شود و این اختلال ممکن است توسط تغییرات بالینی ابتدا به صورت تغییر سطح هوشیاری(LOC) و سپس با پاسخ های غیرعادی تنفسی و وازوموتور ظاهر شود.
بروز هرگونه تغییر ناگهانی در وضعیت بیمار ، نظیر بی قراری(بدون علت مشخص) ، گیجی ، و یا افزایش خواب آلودگی از نظر عصبی دارای اهمیت می باشد. این علایم ممکن است در نتیجه ی فشرده شدن مغز به علت تورم ناشی از خونریزی یا ادم ، گسترش ضایعات داخل جمجمه(هماتوم یا تومور) ، یا ترکیبی از هر دو عامل به وجود آمده باشند.
با افزایش ICP ، بیمار وارد حالت استوپور(stuporous) می شود ، که تنها به محرک های شنوایی با صدای بلند یا دردناک پاسخ می دهد. در این مرحله ، اختلال جدی به گردش خون مغز وارد می شود و ممکن است بلافاصله به مداخله جراحی نیاز باشد. هر چه قدر عملکرد عصبی وخیم تر شود و بیمار وارد حالت کماتوز شود ، پاسخ های حرکتی غیر عادی به شکل دکورتیکه(decortication) ، دسربره(decerebration) یا وضعیت فلکسید(flaccidity) خود را نشان می دهند. وقتی که کما عمیق شود ، و مردمک ها گشاد شده و حالت ثابت پیدا کنند و تنفس مختل گردد ، مرگ معمولا غیر قابل اجتناب خواهد بود.
تا زمانی که ICP به سطحی نرسد که ایسکمی موضعی را ایجاد نماید ، ادم مغزی به تنهایی ناهنجاری های نورولوژیکی بالینی را ایجاد نخواهد کرد. در یک وضعیت بالینی ، تغییر سطح هوشیاری(LOC) ، ظاهر شدن برادی کاردیا ، افزایش در فشار خون ، الگوهای تنفس غیر طبیعی ، تغییر اندازه مردمک ، و پاسخ پلانتار اکستنسور در طرف ضایعه بایستی ظن قوی به ادم مغزی را بالا ببرد. شایعترین علت تباه شدگی نورولوژیکی و مرگ در حین سکته مغزی ایسکمیک حاد ، ادم مغزی است. آن در تمامی سکته های مغزی ایسکمیک بروز می کند. ادم مغزی ایسکمیک در ابتدا به علت اختلالات در غشاهای سلول سیتوتوکسیک نشات می گیرد ، بعدا ادم وازوژنیک به واسطه ی اختلال سد خونی مغزی ایجاد می گردد. ادم مغزی معمولا کمی بعد از ایسکمی شروع شده و در 24-96 ساعت به حد نهایی خود می رسد ، که معمولا به ناحیه ایسکمی محدود بوده و به طور قابل ملاحظه در اطراف مغز تاثیر نمی گذارد. اما با پیشروی ، نواحی مغز اطراف ناحیه ایسکمی را فشرده ساخته و باعث بدتر شدن عملکرد عصبی می شود.
بررسی ها ، تشخیص و مانیتورینگ
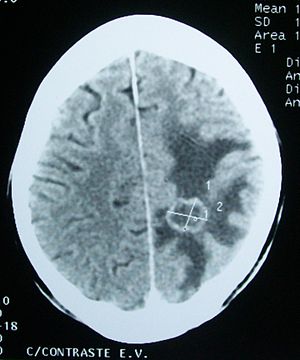
سی تی اسکن یک ابزار بسیار خوب برای تعیین ناهنجاری ها در میزان آب مغز می باشد. نواحی از ادم بر روی اسکن به صورت تراکم کم آشکار می شوند. این به واسطه ی رقیق شدگی تمامی اجزای تشکیل دهنده ی ماده ی سفید است. ویژگی آناتومیکی CT امکان ردیابی و شناسایی ادم و نوع آن را فراهم می نماید. این در تشخیص ماهیت ضایعه نهفته مانند انفارکتوس و یا تومور موثر است. به طور کلی ، تومورهای بدخیم تر اولیه مغز و تومورهای متاستاتیک ، بیشترین بروز ادم مغزی را پوشش می دهند ، اگرچه حضور ادم مغزی ، ضایعات خوش خیم را نفی نمی کند. CT اسکن یک روش بسیار خوب برای دنبال نمودن رفع و برطرف سازی ادم مغزی به دنبال بررسی درمان می باشد. ادم مغزی در ضایعات عروقی حاد می تواند در کورتکس و در زیر ماده سفید مشاهده شود. ادم مغزی در هماتوم اپیدورال و اینتراسربرال معمولا محدود به ماده سفید است.
MRI ظاهرا نسبت به CT در شناسایی تورم مغزی و نیز ادم مغزی حساس تر است. مانیتورینگ و پایش ICP ابزار مهمی جهت مانیتورینگ مواردی است که در آن ادم مغزی حضور دارد یا پیش بینی می شود و در تمامی بخش های مراقبت ویژه(ICUs) نورولوژی و جراحی مغز و اعصاب به صورت روتین انجام می گیرد. متاسفانه ، اندازه گیری مستقیم ICP و اقدامات تهاجمی برای مقابله با فشارهای بالا نتایج سودمند مشابهی را نداده است و بعد از دو دهه محبوبیت ، استفاده روتین مانیتورینگ ICP بحث برانگیز باقی مانده است. مشکل تا حدودی ممکن است موضوع زمان بندی مانیتورینگ و انتخاب صحیح بیماران برای درمان تهاجمی ICP افزایش یافته باشد. تنها در صورتی که اندازه گیری های ICP قرار باشد که به عنوان راهنما برای درمان پزشکی و زمان بندی فشار کاهی جراحی استفاده شود ، قرار دادن مانیتور در مغز بیمار تایید می شود. علایم و نشانه های بالینی و داده های تصویربرداری در مورد شیفت بافت مغزی احتمالا سودمندتر هستند. EEG در کنترل ادم مغزی بسیار کمک کننده است ، زیرا تغییراتی که یادداشت می شوند ، مجموع کلی تغییرات به واسطه ی ادم مغزی ، ICP افزایش یافته ، و ضایعه اولیه منطبق شده بر روی دیگری می باشند.
اغلب تشخیص درصد ادم مغزی در بیمار تنها بر مبنای معاینه بالینی ساده نمی باشد. بدتر شدن نقائص مهم ممکن است در بیماران دارای ادم موضعی مشاده گردد اما اغلب ، پیشروی ادم منجر به کاهش سطح هوشیاری به واسطه ی افزایش فشار داخل جمجمه ای می شود. لذا ، تشخیص صحیح ادم مغزی و مشخص سازی قابل اطمینان از حضور آن بستگی به استفاده از مطالعات تصویربرداری دارد. بیمار ممکن است تحت بررسی آنژیوگرافی مغزی ، اسکن توموگرافی کامپیوتری(CT) یا سی تی اسکن ، تصویر برداری رزونانس مغناطیسی(MRI) ، یا توموگرافی از طریق انتشار پوزیترون(PET) قرار گیرد. مطالعات ترانس کرانیال داپلر اطلاعاتی را در خصوص جریان خون مغزی فراهم می آورند. بیماری که دارای ICP بالایی است ، ممکن است تحت پایش یا مانیتورینگ الکتروفیزیولوژیک قرار گیرد تا جریان خون مغزی به صورت غیر مستقیم مانیتور شود. پایش و مانیتورینگ پتانسیل فراخوان ، پتانسیل های الکتریکی ایجاد شده توسط بافت عصبی در پاسخ و واکنش به محرک های خارجی(حسی ، شنوایی و بینایی) را اندازه گیری می کند. پونکسیون کمری(LP) یا گرفتن مایع مغزی نخاعی در بیمارانی که افزایش ICP دارند خودداری می شود چرا که کاهش ناگهانی فشار می تواند موجب فتق و بیرون زدگی مغز شود.
سی تی اسکن ، ادم را به صورت یک سیگنال هیپودنس(کم تراکم) نشان می دهد. و محوشدگی تقاطع ماده سفید-خاکستری ، افت تفکیک هسته ی لنتیکولار و کاهش مشاهده ی شیار سر ، اینسولا و سیسترن ها را به وجود می آورد. با اینکه ادم وازوژنیک را می توان از حضور کم تراکمی به دنبال مسیر راه های ماده سفید استنباط نمود ، سی تی اسکن در تشخیص ادم وازوژنیک از ادم سیتوتوکسیک موثر نمی باشد.
اسکن ام آر آی ، ادم را به صورت سیگنال کم تراکم(hypointense) در توالی های T1-weighted و سیگنال پر تراکم(hyperintense) در توالی های T2-weighted و FLAIR نشان می دهد. توصیف گسترش ادم در اسکن ام آر آی واضح تر است. به علاوه ، تاکید مجدد بر کمیت تصویربرداری diffusion-weighted در تشخیص نوع ادم بر اساس ضریب نفوذ ظاهری آن(کم در تورم سیتوتوکسیک و زیاد در ادم وازوژنیک) حائز اهمیت است.
فتق و هایپرتانسیون یا پرفشاری داخل جمجمه ای از شایع ترین عوارض ادم مغزی گسترده می باشند. فشار داخل جمجمه ای بایستی در بیماران دچار آسیب مغزی تروماتیک شدید مانیتور گردد که دارای نمره مقیاس کمای گلاسکو(GCS) کم تر از 9 و سی تی اسکن غیرعادی یا سی تی اسکن نرمال هستند اما دو معیار یا بیشتر در زیر مشاده می شود: سن بالای 40 سال ، پوسچرینگ حرکتی یک طرفه یا دو طرفه ، فشار خون سیستولیک زیر 90 میلی متر جیوه.
برخی متخصصان طرفدار مانیتورینگ ICP در بیماران کماتوز دارای ضایعه توده ای وسیع داخل جمجمه ای(هماتوم ، آبسه ، انفارکتوس های بزرگ و غیره) به وجود آورنده ی شیفت بافت هستند. بیماران دارای هموراژ ساب آراکنوئید ، هموراژ اینتراسربرال ، یا سکته های ایسکمیک سربرال یا هموراژیک به وجود آورنده ی هیدروسفالی حاد ، زمانی که سوند ونتریکولوستومی برای اهداف درناژ قرار داده شده است ، ICP آنها معمولا مانیتور می گردد.
درمان
روش های درمان شامل اسموتراپی ، استفاده از مانیتول ، دیورتیک ها و فشار زدایی کردن جراحی هستند.
1- اسموتراپی
اسموتراپی سریع ترین و موثرترین روش کاهش آب بافتی و حجم مغزی است. اسموتیک تراپی با هدف بیرون کشیدن آب از مغز توسط گرادیان اسموتیک و کاهش ویسکوزیته خون می باشد. این تغییرات ICP را کاهش و جریان خون مغزی(CBF) را افزایش خواهند داد.
مانیتول رایج ترین عامل اسموتیک است. اسموتیک تراپی با استفاده از مانیتول ، ICP را بوسیله ی مکانیزم هایی کاهش می دهد. مانیتول حجم مغز را با کاهش مقدار کلی آب ، حجم خون را با اتساع عروقی ، و حجم مایع مغزی نخاعی را با کاهش مقدار آب کاهش می دهد. همچنین مانیتول ممکن است با کاهش ویسکوزیته یا تغییر رئولوژی گلبول قرمز ، پرفیوژن مغزی را بهبود دهد. و بالاخره مانیتول ممکن است تاثیر مثبتی در مقابل آسیب بیوشیمیایی ایجاد نماید.
برخی شواهد وجود دارند که دوز پایین کاملا موثر می باشد که از ایجاد مشکلات هایپراسمولار جلوگیری می کند. هنگام مصرف مانیتول ، بایستی متوجه اسمولالیتی پلاسما برابر 300-310 mOsm/L با ثابت نگه داشتن حجم کافی پلاسما بود. مصرف طولانی مدت مانیتول منجر به عدم توازن الکترولیتی شده که ممکن است فواید آن را تحت تاثیر قرار دهد و بایستی به دقت تحت نظارت و کنترل باشد. مراقبت پرستاری بیماری که مانیتول دریافت می کند مستلزم مانیتورینگ و پایش مستمر الکترولیت ها و توازن کلی سیال و مراقبت از پیشروی عوارض قلبی-ریوی علاوه بر ارزیابی نورولوژیکی است.
سرم مانیتول در موارد زیر انفوزیون می شود:
الف) وجود علائم هریناسیون یا فتق مغزی(میدریازشدن)
ب) وجود علائم Mass-effect مانند همی پارزی
ج) افت شدید و ناگهانی قبل از انجام سی تی اسکن
د) بعد از انجام سی تی اسکن چنانچه علائم فشار داخل مغز یا هماتوم وجود داشته باشد.
ه) در بیماران هرنی ساقه مغز(مرگ مغزی) جهت برگشت احتمالی عملکرد مغز
باید توجه داشت که جهت انفوزیون مانیتول موارد ذیل حتما مورد توجه قرار گیرند:
-هیپوتانسیون: سرم مانیتول به دلیل گرفتن حجم در گردش داخل عروق بیمار باعث افت فشار می شود.
- وجود اختلالات انعقادی
- نارسایی های قلبی (CHF) و ادم ریوی.
مراقبت های پرستاری مورد نیاز جهت انفوزیون مانیتول:
-مدت زمان انفوزیون مانیتول باید کمتر از 15 الی 20 دقیقه باشد.
- سرم مانیتول حتما با کنترل فشار خون انفوزیون شود.
- سرم مانیتول حتما با ست خون انفوزیون شود.
- از نظر نداشتن کریستال کنترل شود و چنانچه کریستالیزه شده با گرم نمودن کریستال های مانیتول ذوب شود.
- بیمار از نظر کنترل دقیق I&O چک شود که نیاز است حتما سونداژ ماندگار ادراری بشود.
- کنترل دقیق الکترولیت به عمل آید.
- در بیماران CHF با کنترل دقیق قلبی تجویز شود.
- بیمار از نظر ادم ریوی تحت نظر باشد.
- سرم مانیتول نباید به یکباره قطع شود بلکه باید Taper-DC شود.
سرم مانیتول از مولکول درشت قند مانیتول تشکیل شده و محلول هایپراسمولار می باشد. غشای عروق و دیواره سلولی نسبت به ورود و خروج مواد نفوذ پذیری انتخابی دارد یعنی اینکه به مولکول هایی به قطر مشخص اجازه عبور می دهد یا بالعکس. قند مانیتول از مولکولهایی است که از دیواره عروق عبور نمی کند و باعث افزایش اسمولاریته در عروق و در نهایت شیفت مایع از بافت به عروق می شود. برای اینکه نفوذناپذیری دیوار عروق نسبت به قند مانیتول به هم نخورد باید مدت زمان توقف قند مانیتول کنار سلول های دیوار عروق تا حد امکان کوتاه شود. برای این کار اولا بایستی انفوزیون مانیتول به موارد نیاز محدود شود ثانیا با سرعت انفوزیون شود. البته انفوزیون های مکرر و همچنین آسیب های موجود در دیوار عروقی در مغز باعث می شود مولکول های مانیتول تاحدی از دیواره ی عروق عبور کرده و در بافت مغز جایگزین شود. در این حالت مواقعی که مانیتول درون عروق وجود نداشته باشد اسمولاریته بافت بالاتر بوده و تاحدی مایع از عروق به سمت بافت شیفت می کند و باعث افزایش ادم مغزی می شود که اصطلا حا به آن پدیده Rebound می گویند . لذا نباید سرم مانیتول به یکباره DC شود بلکه باید به تدریج قطع شود یا به عبارتی Taper –DC شود.
2- دیورتیک ها
تاثیر اسموتیک می تواند با استفاده از دیورتیک های لوپ یا حلقوی(نظیر فورزماید) بعد از انفوزیون عامل اسموتیک ادامه یابد. دیورتیک های حلقوی(فورزماید) می توانند به عنوان یک عامل فرعی استفاده شوند. فورزماید(0.7 mg/kg) نشان داده است که برگشت گرادیان اسموتیک مغزی تثبیت شده با عوامل اسموتیک توسط دفع آب را تداوم می بخشد. ديورتيكهای حلقوی شامل فورزماید ، بومتانید و اتاکرینیک اسید ، قویترين ديورتيك های در دسترس هستند. آن ها كانال های سديم و كلرايد را در بخش صعودی قوس هنله نفرون مهار می كنند و از باز جذب سديم جلوگيری می كنند و همین امر منجر به افزايش ترشح ادرار می شود. این دسته از مدرها اتساع عروق محيطی را به اندازه ديورتيك های تيازيدی كاهش نمی دهند. بنابراين همه جانبه عمل نكرده و به اندازه كافی در كاهش فشار خون موثر نيستند. به منظور افزايش ادرار ديورتيك های لوپ از تيازيدها بسيار موثرترند و به طور متداول بيشتر در درمان بيماران با حجم بالای مايع به كار می روند. با اثر بر روی قوس هنله موجب افزایش دفع کلسیم ، پتاسیم و آب می شود.
کاهش سدیم خون ، هیپوکالمی و هیپومنیزیمی ، آلکالوز ناشی از کمی کلرور خون ، افزایش دفع کلسیم ، کاهش فشار خون ، تهوع ، اختلالات گوارشی ، افزایش اوره خون و نقرس ، افزایش موقت غلظت کلسترول و تری گلیسرید پلاسما با مصرف این دارو گزارش شده است.
3- کورتیکواستروئیدها
با توجه به نقش مهمی که گلوکوکورتیکوئیدها در تخفیف پاسخ های ایمنی دارند تعداد زیادی دارو براساس این اسکلت ساختمانی با فرمول های شیمیایی شبیه هم ساخته شده است که به آنها استروئید ، کورتیکواستروئید و یا کورتون گفته می شود. داروهای کورتیکواستروئید از پرکاربردترین داروها در پزشکی هستند که در بیماری های گوناگونی مانند حساسیت ، بیماری های خود ایمنی و التهاب به کار می روند. از این داروها می توان بتامتازون ، هیدروکورتیزون ، تریامسینولون ، فلوتیکازون ، پردنیزولون و غیره را نام برد که به شکل آمپول ، قرص ، قطره ، اسپری و غیره تولید می شوند.
کورتیکواستروئیدها ، فشار داخل جمجمه ای را عمدتا در ادم وازوژنیک ، بخاطر تاثیر سودمند خود بر روی عروق خونی پایین می آورند. آنها در ادم سیتوتوکسیک کمتر موثر بوده اند و در درمان ادم ثانویه تا سکته مغزی یا خونریزی مغزی پیشنهاد نمی شوند. در واقع عوارض سیستمیک استروئیدها می تواند وضعیت بیمار را وخیم تر نماید. کورتیکواستروئیدها در سکته مغزی موثر نبوده اند. Inj Dexamethasone 4-6 mg IM هر 4-6 ساعت ممکن است در این موارد سودمند باشد. آنها همچنین در مننژیت حاد و مننژیت حاد باکتریایی زیر پوشش آنتی بیوتیک ها به کار برده شده اند. گلوکوکورتیکوئیدها برای کنترل تومورهای مغزی بدخیم ، اولیه یا ثانویه ، به عنوان شیمی درمانی کمکی از برخی تومورهای سیستم عصبی مرکزی(CNS) و در جراحی مغز استفاده می شوند. ادم اطراف تومورهای مغز خصوصا تومورهای متاستاتیک به طرز چشمگیر برای درمان با دوزهای بالا از دگزامتازون پاسخ می دهند. گلوکوکورتیکوئیدها تاثیر خود را بر روی تومورهای مغزی اساسا با کاهش ادم وازوژنیک مرتبط با تومور ، با پایین آوردن نفوذپذیری مویینگی افزایش یافته از سد خونی مغزی انجام می دهند. نقش کورتیکواستروئیدها در ترومای سر مشخص نیست.
4-هایپرونتیلاسیون
هایپرونتیلاسیون کنترل شده در کاهش یا افزایش ICP کمک کننده است. پایش تاثیرات ونتیلاسیون به طور دقیق با آنالیز گاز خون و رادیوگراف سینه حائز اهمیت است. PCO2 نبایستی زیر 25 میلی متر جیوه کاهش یابد. در این نقطه تاثیر تنگ کننده عروقی هیپوکاربیا باعث هیپوکسی و آسیب سلولی ایسکمیک خواهد شد.
5- سایر عوامل
سدیت یا دادن آرام بخش به بیماران حین اینتوباسیون نبایستی فراموش شود. از جمله فواید سدیت کردن بیماران تروما به سر عبارتند از:
1-در صورت نیاز به لوله گذاری یا اینتوباسیون حین و بعد از آن سدیت کردن بیمار و همچنین استفاده از لیدوکائین به صورت IV یک الی دو دقیقه قبل از آن از زور زدن بیمار و افزایش ICP جلوگیری می کند.
2-سدیت کردن بیمار با جلوگیری و سرکوب درد بیمار خصوصا بیماران تروما چندگانه مثل شکستگی های اندام و به خصوص حین نقل و انتقال تاثیر به سزایی در جلوگیری از افزایش ICP دارد.
3-استفاده از باربیتورات ها برای خواباندن بیمار علاوه بر سدیت کردن بیمار همچنین باعث تنگ شدن عروق نرمال مغزی شده و در نیتجه خون از مناطق سالم مغز به مناطق ایسکمیک شیفت می کند(که به آن فنومن رابین هود نیز گفته می شود).
4-سدیت کردن بیمار باعث کاهش میزان نیاز متابولیک و مصرف اکسیژن مغز می شود.
5-سدیت کردن بیماران مغزی با کاهش کاتابولیسم باعث کاهش ICP می شود.
البته در استفاده از گروهی از آرام بخش ها مثل دیازپام و مرفین حتما باید بیمار را از نظر دپرسیون مرکز تنفسی کنترل کرد.
سایر عواملی که مورد آزمایش قرار گرفته اند شامل باربیتورات ها ، مشتقات پروکائین ، ایندومتاسین ، پروپوفول و THAM(ترومتامین) می باشند که در گذشته استفاده می شده اند اما امروزه به صورت روتین استفاده نمی شوند.
باربیتورات ها کاهش چشمگیری در نرخ متابولیکی به وجود می آورند. عوارض باربیتورات درمانی در هیپوتانسیون سیستمیک و اختلال ریوی ، ایجاد نگرانی نموده است و پایش دقیق با یک سوند یا کاتتر Swan Ganz توصیه می شود.
لیدوکائین از افزایش ICP در طول لوله گذاری یا اینتوباسیون جلوگیری خواهد نمود. ممکن است مستقیما بر روی مرکز وازوموتور یا محرک عروق ساقه مغز عمل نماید. THAM جهت تنظیم آسیب اسیدوتیک اتورگلاسیون مغزی به کار برده می شده است و پاسخ سیستم عروقی به هیپوکاپنیا می تواند بهبود داده شود.
مکانیسم اصلی پروپوفول هنوز شناخته نشده است ولی به نظر می آید که با اثر تحریکی بر جزء بتا یک گیرنده GABA سبب فعال شدن کانال های کلر و در نتیجه مهار سیناپس می شود. اثر دیگر آن مهار جزء NMDA گیرنده ی گلوتامات است. پروپوفول مانع از افزایش ICP پس از لوله گذاری ، کاهش فشار مایع مغزی نخاعی ، افزایش مقاومت عروق مغزی ، کاهشIOP ، ضد تهوع و استفراغ ، ضد خارش (با دوز کم) ، کاهش تاکیکاردی و هایپرتانسیون پس از لوله گذاری ، کاهش مشکلات تنفسی پس از لوله گذاری می شود. عوارض جانبی پروپوفول عبارتند از: تضعیف قلب(با کاهش فشار خون شریانی ٬ افزایش جبرانی در ضربان قلب صورت نمی گیرد ٬ کاهش حجم ضربه ای) - کاهش فشار خون(کاهش حجم ضربه ای) ، عدم تاثیر بر ضربان قلب(بارورفلکس طوری تنظیم می شود که با کاهش فشار خون ٬ ضربان قلب افزایش نمی یابد) ، برادی کاردی(به دلیل واگوتونیسیته ٬ باعث برادی کاردی واضح بخصوص همراه با سایر داروهای واگوتونیک مثل ساکسینیل کولین یا نارکوتیک ها می شود) ، برادی پنه و آپنه ، افزایش PaCO2 (تضعیف کننده مرکزی تنفس است که هم تعداد و هم عمق تنفس را کاهش می دهد) ، عدم تاثیر بر PaO2 ، افزایش ریسک آسپیراسیون (تضعیف رفلکس گگ)
۶-درمان جراحی
درمان جراحی گاهی مواقع برای انفارکتوس های بزرگ مغزی همراه با ادم و شیفت های مغزی تهدید کننده زندگی توصیه می شود. ونتریکولوستومی یا کرانیوتومی ممکن است جلوی تحلیل رفتن را بگیرند و می توانند نجات دهنده باشند. کرانیوتومی عمل جراحی باز روی مغز است. سوراخی توسط جراح بر روی جمجمه ایجاد می شود به نحوی که عمل روی مغز امکان پذیر باشد.کرانیوتومی ممکن است در هر ناحیه ای از جمجمه انجام شود و می تواند در ابعاد مختلف باشد. تکه ای از استخوان سر که برداشته می شود معمولا مجدد سر جای خود گذارده می شود. کرانیوتومی دکمپرسیو در تنظیم تورم حاد مغزی ناشی از انفارکتوس مغزی یک روش نجات دهنده است و بایستی در بیماران جوانتر که دارای وضعیت نورولوژیکی به سرعت تحلیل رونده ای دارند در نظر گرفته شود. همچنین در انفارکتوس های بزرگ مخچه ای همراه با ادم مغزی ، دکمپرسیون جراحی نجات دهنده زندگی است. حذف ضایعات به وجود آورنده ی ادم مغزی به کمک جراحی منجر به برطرف شدن ادم مغزی می گردد.
جراحی های داخل جمجمه ای(intracranial surgery):
کرانیوتومی(craniotomy) شامل باز کردن جمجمه توسط عمل جراحی جهت دسترسی به ساختمان های داخل جمجمه می باشد. از این روش برای برداشتن تومور ، کاهش ICP ، خارج کردن لخته خون و کنترل خونریزی استفاده می کنند. جراح جمجمه را برش می دهد تا یک زبانه ی استخوانی(bony flap) ایجاد شود ، این زبانه را می توان پس از جراحی و توسط بخیه هایی از جنس سیم و یا ضریع استخوان دوباره در جای خود قرار داد.
عموما دو شیوه برای باز کردن جمجمه وجود دارد که عبارتند از: (1) از بالای چادرینه (کرانیوتومی فوق چادرینه ای یا supratentorial craniotomy) به داخل اجزای واقع در بخش فوقانی چادرینه وارد می شوند ؛ و (2) از زیر چادرینه به داخل اجزای تحتانی چادرینه(سوراخ خلفی یا posterior fossa) وارد می شوند. در روش سوم یا روش ترانس اسفنوئیدی(transsphenoidal) نیز وارد سینوس های دهان و بینی می شوند که این روش برای دستیابی به غده هیپوفیز مورد استفاده قرار می گیرد.
از طریق سوراخ ایجاد شده(burr holes) در سر به وسیله ی مته های مخصوص نیز می توان به ساختمان های داخل جمجمه ای دسترسی پیدا کرد. در این شیوه سوراخ مدوری توسط مته ی دستی یا یک کرانیوتوم اتوماتیک(automatic craniotome) ، دارای سیستم خود کنترلی که با سوراخ شدن استخوان خود به خود مانع از عمل مته می شود ، در جمجمه ایجاد می شود. این سوراخ ها به عنوان بخشی از درمان جراحی در جمجمه ایجاد می شوند.
از طریق سوراخ کردن سر می توان وجود تورم مغزی ، همچنین آسیب دیدگی و اندازه و محل بطن ها را تعیین نمود. به علاوه ، این سوراخ ها وسیله ای برای تخلیه ی هماتوم ها یا آبسه های داخل جمجمه ای هستند و برای ایجاد زبانه های استخوانی در جمجمه و امکان دستیابی به بطن ها جهت کاهش دادن فشار یا دکمپرسیون(decompression) ، پرتونگاری بطنی(ventriculography) و نیز روش های ایجاد شانت(shunt procedures) مورد استفاده قرار می گیرند. سایر روش های جراحی در رابطه با جمجمه عبارتند از: کرانیکتومی(craniectomy) شامل برش و قطع بخشی از جمجمه و نیز کرانیوپلاستی(cranioplasty) شامل ترمیم نقائص جمجمه با کمک صفحات فلزی یا پلاستیکی است.
رسیدگی قبل از عمل(preoperative management):
روش های تشخیصی قبل از عمل عبارتند از: سی تی اسکن برای مشخص نمودن ضایعه و نشان دادن درجات ادم ایجاد شده در اطراف مغز ، اندازه ی بطن ها و تغییر مکان ها.
MRI نیز اطلاعاتی مشابه با سی تی اسکن در اختیار قرار می دهد ، با این تفاوت که تصاویر از کنتراست و تفکیک پذیری بالایی برخوردار هستند و ضایعه در سطوح مختلف آناتومیکی مشخص شده و مورد معاینه قرار می گیرد. از آنژیوگرافی(angiography) مغزی برای بررسی وضعیت خون رسانی به تومور یا جمع آوری کردن اطلاعات پیرامون ضایعات عروقی استفاده می شود. جریان داپلر ترانس کرانیال(Transcranial Doppler flow) نیز برای ارزیابی جریان خون عروق خونی داخل جمجمه کاربرد دارد.
معمولا به اکثر بیماران قبل از عمل جراحی ضد تشنج(antiseizure) نظیر فنوتین(دیلانتین) یا یکی از متابولیت های فنی توئین(Cerebyx) داده می شود تا خطر حملات تشنجی(آشفتگی و نیز اختلالات گذرای حمله ای در مغز به دلیل تخلیه ی غیر طبیعی بار الکتریکی) بعد از عمل کاهش یابد.
قبل از جراحی ، احتمال تجویز کورتیکواستروئیدها نظیر دگزامتازون(دکادرون) نیز جهت کاهش ادم مغزی در بیماران دچار تومور مغز وجود دارد. مصرف مایعات محدود می شود. داروی هایپراسموتیک(مانیتول) و نیز یک دیورتیک نظیر فورزماید(لازیکس) را می توان به صورت داخل وریدی بلافاصله قبل از جراحی و گاهی اوقات در طول عمل جراحی چنانچه احتمال احتباس مایع در بیمار وجود داشته باشد مورد استفاده قرار داد. در صورت احتمال بروز آلودگی و عفونت های مغزی به بیمار آنتی بیوتیک می دهند و برای کاهش اضطراب نیز قبل از عمل جراحی از دیازپام و یا لورازپام استفاده می کنند.
رسیدگی های بعد از عمل(postoperative management):
یک مسیر شریانی و یک مسیر فشار وریدی مرکزی برقرار می شود تا بتوان فشار خون و فشار ورید مرکزی را تحت نظارت دقیق درآورد. ممکن است بیمار اکسیژن مکمل دریافت کند یا برایش لوله گذاری انجام شود. برای شناسایی و کاهش ادم مغزی ، تسکین درد ، پیشگیری از تشنج ، پایش ICP ، و وضعیت عصبی باید به طور مستمر و مداوم بیمار را پس از عمل جراحی تحت کنترل قرار داد.
کاهش ادم مغزی:
درمان دارویی به منظور کاهش ادم مغزی شامل تجویز مانیتول می باشد که اسمولالیته ی سرم را افزایش می دهد و آب آزاد را از مناطق مغزی بیرون می کشد(در صورتی که سد خونی-مغزی سالم باشد). سپس مایعات توسط داروهای دیورتیک اسموتیک دفع می شوند. دگزامتازون نیز ممکن است به مدت 24 الی 72 ساعت هر 6 ساعت یکبار به صورت داخل وریدی تجویز گردد. طریقه ی مصرف باید هر چه سریعتر به خوراکی تغییر یابد و دوز مصرفی به تدریج طی 5 الی 7 روز کاهش یابد.
تسکین درد و پیشگیری از تشنج:
معمولا برای درجه حرارت بالای 99.6 درجه ی فارنهایت(37.5 درجه سانتیگراد) و یا تسکین درد از استامینوفن استفاده می شود. معمولا بیماران بعد از کرانیوتومی دچار سردرد می شوند که ناشی از کشیدگی و تحریک اعصاب سر در حین عمل جراحی است. کدئین اغلب برای تسکین درد کفایت می کند. همچنین برای کنترل درد پس از عمل جراحی در بیماران متحمل کرانیوتومی ، از سولفات مورفین هم استفاده می شود.
در بیماری که تحت عمل کرانیوتومی فوق چادرینه ای قرار گرفته است ، از داروهای ضد تشنج مانند فنی توئین ، دیازپام به صورت پروفیلاکسی استفاده می شود ، چراکه خطر بروز تشنج بعد از روش های جراحی اعصاب در ناحیه ی فوق چادرینه ای وجود دارد.
پایش ICP:
یک سوند بطنی یا نوع دیگری از درناژ اغلب در بیماران متحمل عمل جراحی داخل جمجمه ای کار گذاشته می شود. سوند به یک سیستم یا دستگاه درناژ بیرونی متصل می شود. زمانی که فشار بطنی نرمال و ثابت شود ، سوند برداشته می شود. در صورتی که احتمال انسداد سوند وجود داشته باشد می بایست جراح مغز و اعصاب را مطلع نمود.
بعد از عمل جراحی ، دفعات کنترل دقیق و مکرر بیمار بر مبنای وضعیت بالینی وی تعیین می شود. بررسی عملکرد سیستم تنفسی ضروری است چراکه درجات کمی از هیپوکسی می تواند خطر ایسکمی مغزی را افزایش دهد. توجه به وضعیت تنفسی ضروری به نظر می رسد زیرا کاهش سطح اکسیژن(هیپوکسی) حتی به میزان اندک یا افزایش ناچیز سطح دی اکسید کربن(هایپرکاربیا) بر پرفیوژن مغزی تاثیر گذاشته و می تواند بر روند بیماری و نتایج حاصله از نظر بالینی تاثیر بگذارند. لوله داخل تراشه ای تا زمانی که بیمار علایم بیداری و آگاهی را نشان نداده است و تنفس خود به خود به نحو موثری صورت نپذیرفته(تشخیص این مسئله از طریق ارزیابی بیمار از نظر بالینی و تجزیه ی گازهای خون شریانی انجام می گیرد) در محل باقی می ماند. بعد از جراحی ، مغز تا حدودی دچار ادم می شود(میزان آن 24-36 ساعت بعد از عمل به بالاترین حد خود می رسد) و همین امر منجر به کاهش پاسخ دهی بیمار در دومین روز پس از جراحی می شود.
از چرخاندن بیش از حد سر بیمار باید خودداری شود ، زیرا سبب افزایش ICP می گردد. بعد از عمل جراحی فوق چادرینه ای ، بیمار باید به پشت و یا به پهلو(رو به پهلویی که تحت عمل قرار نگرفته) خوابانده شود و بالشی زیر سر او قرار گیرد. سر تخت مطابق با میزان ICP و تشخیص جراح اعصاب ، در حدود 30 درجه بالا آورده می شود. بعد از انجام جراحی در ناحیه ی سوراخ خلفی(تحت چادرینه ای) بدن بیمار باید صاف و رو به یک پهلو قرار گیرد و بالش کوچک و محکمی نیز زیر سر وی گذارده شود. بیمار را می توان به هر دو پهلو چرخاند ، گردن وی باید صاف و بدون تمایل به راست و چپ باشد. در حین چرخاندن بیمار ، باید کل بدن به طور همزمان به طوف جهت مورد نظر چرخانده شود تا بدین ترتیب از کشیدگی انسزیون و احتمال پارگی بخیه ها جلوگیری به عمل آید. سر تخت را می توان بسته به میزان تحمل بیمار به آرامی بالا برد.
بهبود تبادلات گازی:
بیماری که متحمل جراحی اعصاب شده ، به دلیل عدم تحرک ، پایین آمدن سیستم ایمنی ، کاهش سطح هوشیاری ، و محدودیت مصرف مایعات ، در معرض خطر اختلال در تبادلات گازی و عفونت های ریوی قرار می گیرد. عدم تحرک ، سیستم تنفسی را به مخاطره می اندازد که آن هم به دلیل توقف و نیز تجمع ترشحات در نواحی وابسته و پیدایش آتلکتازی (atelectasis) است. بیماری که دارای محدودیت در مصرف مایعات می باشد ، به دلیل عدم توانایی در خارج کردن ترشحات غلیظ ، بیشتر مستعد آتلکتازی است. غالبا در بیمارانی که جراحی اعصاب داشته اند ، پنومونی نیز مشاهده می شود که می تواند با آسپیراسیون و عدم تحرک در ارتباط باشد. وضعیت بدنی بیمار هر 2 ساعت یکبار تغییر داده می شود تا بدین ترتیب ترشحات به حرکت درآمده و از توقف آنها جلوگیری گردد. ممکن است برای جمع آوری ترشحاتی که امکان خروج آنها توسط سرفه وجود ندارد ، از ساکشن نای و ناحیه دهانی-حلقی استفاده شود ، هرچند سرفه و ساکشن ICP را افزایش می دهند ، بنابراین باید ساکشن را با احتیاط به کار برد.
کنترل اختلال مایع و الکترولیت ها:
به دلیل وضعیت موجود در بیمار و اقدامات کنترلی صورت گرفته برای وی یا در اثر عوارض ناشی از جراحی ، مایع و الکترولیت های بدن دچار عدم تعادل می شوند. اختلالات مایع و الکترولیت ها می تواند به تشکیل ادم مغزی کمک نماید. رژیم مایعات که برای بعد از عمل در نظر گرفته شده ، بر مبنای نوع روش جراحی اعصاب انتخاب گردیده و با توجه به وضعیت فردی بیمار برآورد می شود ، حجم و ترکیب مایعات با تعیین الکترولیت های مورد نیاز روزانه و جذب و دفع آن تنظیم می شود. در بیماران دچار ادم مغزی مصرف مایعات محدود می شود.
عکس العمل سیستم درمانگر در برابر بیماران تروما به سر:
در برخورد با بیماران تروما به سر کنترل سطح هوشیاری و قطر مردمک اهمیت زیادی دارد. همیشه میدریازشدن بیمار خبر از افزایش ICP می دهد. البته ترومای مستقیم به چشم و استفاده از داروهای هم دسته آتروپین نیز می تواند باعث گشادی مردمک بشود که باید به آن توجه شود.
معاینه ی عصبی شامل تعیین سطح هوشیاری ، وضعیت مردمک ها ، حرکات چشم و قدرت موتورعضلات.
برای اندازه گیری سطح هوشاری سه جزء را مورد بررسی قرار داده و طبق مقیاس کمای گلاسکو(GCS) به آن نمره می دهند.
تروما از علل شایع افزایش ICP می باشد که با ایجاد هماتوم یا ادم مغزی منتشر یا هیدروسفالی و به دنبال آن انسداد مسیر جریان CSF ، وازواسپاسم و ترومبوز سینوس های وریدی باعث افزایش ICP می شود. تومورهای مغزی ، عفونت های داخل مغزی و آبسه ی مغزی ، هیدروسفالی و ضایعات عروقی مانند آنوریسم یا AVM از دیگر دلایل افزایش ICP می باشد.
سه علامت شایع در افزایش ICPعبارتند: از سر درد ، استفراغ و ادم پاپی.
استفراغ بدون حالت تهوع بیشتر در افزایش ICP دیده می شود. همچنین اختلال تنفسی بسته به سطح افزایش ICP وجود دارد.